2 「モノ」のおはなし(2):基本事項と濃度
手のつなぎ方や貸し借りのお約束のおはなしです。
最初に結論。
一番外側に8個の電子(というもの)があると、安心していられる状態です。
水素とヘリウムだけは一番外側に2個あればいい特別枠。
結論を意識しながら、具体例を見ていきますよ。
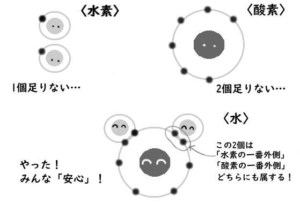
身近な分子、水(H₂O)を見てみると。
水素(H)は、そのままでは一番外側が電子1つだけです。
これでは「1個しかないや…不安だな…」という状態。
酸素は内側に2個の電子が入っていますが、
一番外側には6個の電子しかありません。
これまた「むう…あと2個あれば安心できるのに…」の状態です。
内側にある電子を外に持ってくることはできません。
「内側から埋めていってね、足りなくても外に出しちゃだめよ」
これも化学の世界での決まり事です。
とかく不安な水素2人(?)と酸素1人(?)は、手をつなぐことにしました。
「ねえねえ、電子1つずつ出し合って、手をつながない?」
水素2人(?)は電子の手を伸ばし、
酸素1人(?)も電子の手を伸ばし、手をつないでいるところは共有扱いにしました。
共有…(水素も酸素も)どちらにも属している扱いですね。
これなら、水素の一番外側の電子は
もともとの1個と、酸素と共有している1個で、2個。
水素、不安解消。
酸素の一番外側の電子は
もともとの6個と、水素と共有している1個が2つあって、8個。
酸素も、不安解消です。
みんな安心、良かったね…これが、水分子です。
では、イオンの例。
イオンは「手はつながないよ、物の貸し借りはするよ」でした。
こちらは食塩(NaCⅼ)でいきましょう。
ナトリウム(Na)は、そのままだと一番外側に1個の電子。
7個借りるよりは、1個を貸した方が安心に近そうです。
一方の塩素(Cl)は、そのままだと一番外側は7個の電子。
こちらは、7個貸すより1個借りた方が安心に近いこと、分かりますね。
ここで貸し借りする電子はマイナスの電気。
「1つ貸し出す」ことは、
通常状態からマイナスが1つ減るので「プラス1」になります。
「1つ借りる」ことは、
通常状態からマイナスが1つ増えるので「マイナス1」ですね。
だからナトリウムが安心している状態は
電子を1つ貸し出してプラス1になったナトリウムイオン(Na⁺)。
塩素が安心している状態は
電子を1つ借りてマイナス1になった塩化物イオン(Cⅼ⁻)。
プラスとマイナスは電気的に引き合いますから、
ナトリウムイオンと塩化物イオンがくっついて…
おなじみの「食塩(NaCⅼ)」ができているのです。
でも、イオンは手をつながないドライな関係。
不安を感じない環境や、もっと都合の良い友達を見つけると
さっさと離れてしまいます。
それが「水中でのイオン解離」につながっていくのです。
…次回は、看護に関係する「濃度」についておはなししますね。