5 電離平衡・中和(1):体のpHを守るために
ここのおはなしは、pHを理解するためのもの。
pHというのは、酸性度合い・アルカリ性度合いを示すもの。
リトマス試験紙に液体をつけたときに色を変えるものについて、
もう少し細かく理解してあげましょうね…というおはなしです。
なぜpHを理解しないといけないのか。
ヒトの細胞が元気に生きていられるpHの幅は、結構狭いんです。
大事なことなので、先に数字だけ説明しちゃいますね。
ヒト血液の正常域はpH7.35~7.45。
pH7.40±0.05と書くこともあります。
この、たったpH0.1の幅を外れると、細胞にとって異常事態のスタート。
あまりに正常域から外れてしまうと、細胞は死んでしまいます。
だからpHについてある程度までは理解しておく必要があるのです。
pHの理解のためには、電離平衡のおはなしから。
大前提は、水分子はH₂Oというところからです。
水は、この水分子(水の粒)がたくさん集まったもので、
一定の温度のもとでは一定の範囲内を自由に動き回れる…
ここまでは、いいですね。
さらによく見てみると。
H₂Oの粒の中に、H⁺とOH⁻というさらに別な粒がいることが分かりました。
「水分子はH₂O」と思いきや、
実はごく少数のH⁺やOH⁻も含まれていたのです!
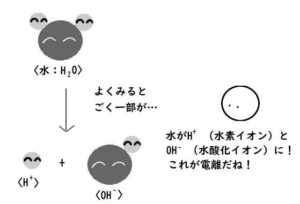
どれくらい少ないかというと、
水の粒10⁷(=10,000,000:1000万個)のうち
1個がH⁺とOH⁻に分かれているくらい。
H₂OがH⁺とOH⁻に分かれていることを「電離」と呼びます。
プラスイオンとマイナスイオンに分かれるものは「電離」。
プラスイオンとマイナスイオンに分かれないものは「解離」と言います。
話を水の電離に戻して。
ある日、とある研究者は気付きました。
「水の粒(H₂O)とH⁺とOH⁻は、
一定の関係で釣り合いを取っているらしいぞ!」
これを「H₂O⇔H⁺+OH⁻」と表します。
水がつり合っている(平衡)状態なので、「水の平衡状態」ですね。
さらに研究を進めたところ、
25℃では水素イオンの濃度([H⁺])と水酸化イオンの濃度([OH⁻])は
水1リットル中に1×10⁻⁷モルしかないことも分かりました。
これを「Kw=[H⁺][OH⁻]=1.0×10⁻¹⁴」と表します。
Kwは水が電離している度合いを示す係数です。
次回、もう少し用語説明をしてから
血液をはじめヒトのpHを確認していくことにしましょうね。