2 「モノ」のおはなし(3):基本事項と濃度
お待たせしました。
看護に関係のある「濃度」のおはなしです。
「…どこが?」と言われてしまいそうですが。
濃度は、点滴(輸液)や希釈(薄める)のベースになっています。
看護師国家試験の計算問題で出てきますので、
しっかり理解しておきたいところですね!
点滴や希釈で大事になってくるのは
「お薬等の濃さ(どれくらい含まれているか)」です。
なぜ重要か、については薬理学や微生物学にお任せしちゃいますよ。
少なくとも
「その薬の成分さえ入っていればいい!」という話ではないのです。
「どれくらい含まれているか」ということは
「その薬を構成する最小単位が何個あるか」ということ。
…『何個あるか』と簡単に言いましたが。
この化学の世界はあまりに小さすぎて、普段は目に見えません。
見ようとするなら、超強力な顕微鏡が必要です。
しかもそんなのを見ながら「1個、2個…」と数えて毎日の点滴を作るなんて、
時間が足りませんし、現実的でもありませんね。
どうするのか。
たくさん集めて、重さから個数を知ることにしたのです。
最小単位になる粒は、1個では軽すぎて重さを量れたものではありません。
だから、たくさん集めて日常的な単位(g)で量ることにしました。
集める個数は「6.02×10²³個にする」のがお約束です。
これをアボガドロ数と呼んでいます。
「粒をこの個数集めると、量りやすい重さになるぞ!」と
昔の偉い人(アボガドロさん)が決めたことなので、
ありがたく使わせてもらいましょう。
「10²³」というのは10を23回かけた数のこと。
そんなに大きな数は書くのも読むのも大変なので、
「10²³」と示すことにしています。
「10の23乗(じょう)」と読みますよ。
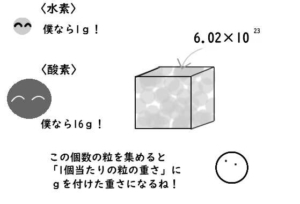
同じ種類の粒を10²³個集めると、
「粒の1個あたりの重さ」にg(グラム)の単位を付けたものになります。
「粒の1個当たりの重さ」は、
粒が原子なら「原子量」、粒が分子なら「分子量」、
粒がイオンなら「式量」と呼んでいます。
具体例で確認。
水(H₂O)分子の分子量を見てみましょう。
水素(H)の重さは1、酸素(O)の重さは16と決められています。
Hが2個と酸素が1個で水ですから、
H₂Oの分子量は1+1+16=18ですね。
だから、水分子(水の粒)を6.02×10²³個集めると、18gになります。
粒の重さと原子量、分子量、式量とアボガドロ数の関係はとても便利なもの。
どんどん使っていってください。
他にも化学のお約束はたくさんあります。
便利なものばかりですので、
必要になったら説明していきますからね。
次回は濃度そのもののおはなしに入ります。