2 「モノ」のおはなし(4):基本事項と濃度
点滴の前におはなししておかないといけないこと、
それが濃度(濃さ)です。
最初はイメージしやすい「固まり(固体)が水に溶けた」で。
黒糖やブラウンシュガーのように、溶けたものに色がついていれば
大まかな色の濃さで濃い・薄いは分かりますね。
でも、上白糖(いわゆるお砂糖)だと、色の違いで濃さを判断できません。
それに微妙な濃さの違いは、色付きであっても判断できませんね。
そこで、もっとしっかり(まじめに?)濃さを知りたいときには
濃度計算をすることになります。
何に注目するかによって濃度にもいろいろありますが…
「質量パーセント濃度(%)」と
「モル濃度(mol/ℓ)」は必ず理解してくださいね。
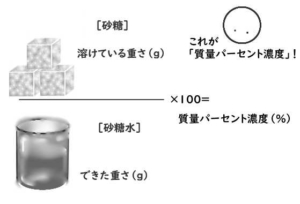
「質量パーセント濃度」は、
「できた溶けている『液体の重さ(g)』のうち、
『溶けているものの重さ(g)』は何%ですか?」を見ています。
溶かそうとする物の重さ(g)と、
できた液体の重さ(g)が分かれば、計算できそうですね。
具体例でいきましょう。
砂糖(溶かそうとする物)18gを水に溶かしたら、
100gの液体ができたとします。
このできた液体の質量パーセント濃度は、
(18g÷100g)×100=18%になります。
分母(下)ができた液体の重さ、分子(上)が溶かそうとする物の重さ、
この割合を100分率(%)で出すので、最後に100をかけています。
教科書に書いてある溶媒、溶質、溶液という言葉に対応させると…。
溶媒は溶かすための水、
溶質は溶かそうとする砂糖、
溶液ができた砂糖水ですね。
これらの言葉は堅苦しいものですが、
文字数を減らすうえで有効なので、早めに慣れてくださいね。
「モル濃度」は、
「できた溶けている液体(ℓ)のうち、
溶けている物は何モルですか?」を見ています。
「モル」というのは、一種の単位。
「粒を6.02×10²³個集めたときに、1モルと呼ぼうねー」と決められたもの。
この数字、見覚えありますね。
原子量、分子量、式量で出てきたアボガドロ数です。
水の分子量が18で、6.02×10²³個集めると18g…は前回のおはなし。
だから水なら18gで1モル、36gあれば2モルです。
砂糖にはいろいろありますが…
例えば、グルコース(ブドウ糖)という糖はC₆H₁₂O₆です。
これは炭素6個、水素12個、O6個で安心している…という分子。
炭素(C)の重さは12ですから、分子量を出すと
(12×6)+(1×12)+(16×6)=180になります。
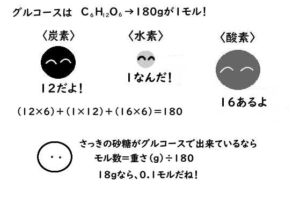
分子量が分かればモル濃度は簡単。
グルコースが180gで1モルですから、18gなら0.1モルですね。
だから、水(溶媒)1ℓにグルコース(溶質)18gが溶けた液体があったら、
その液体(溶液)のモル濃度は0.1モル/ℓ(=0.1mol/ℓ)になります。
ここまで分かれば、点滴や消毒液希釈の基本
「濃度」はオッケーです。
後は必要に応じて、必要な濃さの溶液を作るだけです。
看護の世界では質量パーセント濃度が使われることが多いので、
意識して使いこなせるようになってくださいね。